Cofepris publica guía para el registro de medicamentos y dispositivos médicos

Foto Internet
Miércoles 20 de Diciembre de 2023 6:32 pm
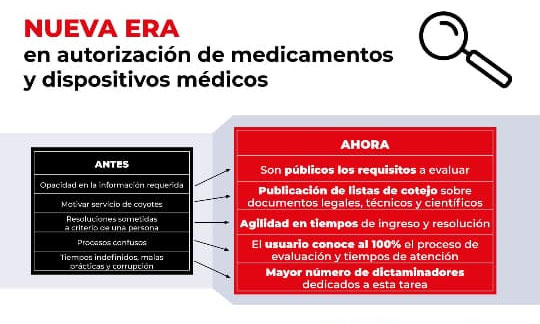
+ -Las nuevas guías detallan los requisitos esenciales, tanto científicos, técnicos como legales, que deben cumplir los dispositivos médicos
La Comisión Federal para la
Protección contra Riesgos Sanitarios (Cofepris) anunció hoy la publicación de
guías detalladas para el registro sanitario de medicamentos y dispositivos
médicos, incluyendo software médico. Este lanzamiento marca un hito en la
transparencia y eficiencia del proceso de registro, poniendo fin a la era de
opacidad en la obtención de estos registros.
Las nuevas guías detallan los
requisitos esenciales, tanto científicos, técnicos como legales, que deben
cumplir los dispositivos médicos, clasificados en categorías de riesgo I, II y
III. Además, se incluye información relevante para los softwares médicos, con
el objetivo de garantizar su seguridad y eficacia.
Por otro lado, la guía para medicamentos ofrece un procedimiento claro para el registro de productos genéricos, moléculas nuevas, medicamentos biológicos y vacunas. Este esfuerzo busca agilizar los procesos de ingreso y resolución de solicitudes, permitiendo un acceso más rápido y seguro a productos esenciales para la salud.
Desde 2005, los registros sanitarios
tienen una vigencia de cinco años, con posibilidad de extensión. La Cofepris
facilita estos trámites a través de la plataforma Digipris, en línea.
La información sobre los trámites
requeridos está disponible en el Registro Federal de Trámites y Servicios de la
Comisión Federal de Mejora Regulatoria (Conamer).
La publicación de estas guías refleja
el compromiso de Cofepris con la transparencia y la regulación eficiente,
beneficiando tanto a las industrias reguladas como a los pacientes, y
fomentando el desarrollo continuo de innovaciones tecnológicas en el sector
salud.
.png)

1.png)